6月4日,圣湘生物乙型肝炎病毒核糖核酸 (HBV RNA) 檢測試劑盒 (PCR-熒光探針法) 通過國家藥品監(jiān)督管理局審核,獲批上市。這不僅是圣湘生物在肝炎診斷領(lǐng)域的重要突破,也讓公司成為中國首家HBV RNA和HBV DNA檢測產(chǎn)品均獲批上市的企業(yè)。

HBV RNA檢測試劑盒可用于定量檢測臨床血清樣本中的乙型肝炎病毒(HBV)RNA,檢測結(jié)果可作為乙型肝炎感染者臨床診療的重要輔助指標之一,若廣泛應(yīng)用于臨床診斷,可以幫助醫(yī)生更準確了解患者的病情進展和治療效果,為個體化治療方案的制定提供有力支持。同時,該試劑盒檢測靈敏度達50 copies/mL,線性范圍達1.0E+02 copies/mL~1.0E+09 copies/mL,能滿足不同醫(yī)療機構(gòu)和臨床場景的需求,為肝炎防治工作提供全面、便捷的解決方案。
存在于肝組織內(nèi)的共價閉合環(huán)狀DNA(cccDNA)是HBV復(fù)制的源頭,與慢性持續(xù)性感染和CHB難以治愈密切相關(guān)。cccDNA的檢測需要有創(chuàng)的肝穿活檢,無法廣泛開展,因此探索能夠反映肝組織內(nèi)cccDNA存在及轉(zhuǎn)錄活性的血清替代指標,以客觀評價抗病毒療效及判定合適的停藥時機是當下亟需。

我國《慢性乙型肝炎防治指南(2022年版)》、《慢性HBV感染者血清HBV RNA檢測及臨床應(yīng)用的專家共識》和歐洲肝病學(xué)會的《乙型肝炎病毒感染管理臨床實踐指南(2017年版)》均指出,血清HBV RNA水平可反映肝組織cccDNA轉(zhuǎn)錄活性,與患者的病毒學(xué)應(yīng)答及預(yù)后相關(guān)。2019年EASL和美國肝病學(xué)會聯(lián)合發(fā)表的HBV治療終點會議報告也提出,將血清HBV RNA作為cccDNA存在和轉(zhuǎn)錄活性的測定指標。
HBV RNA主要由肝細胞核內(nèi)的cccDNA模板轉(zhuǎn)錄生成,可用于無創(chuàng)性地反映cccDNA的轉(zhuǎn)錄活性。通過血清檢測即可獲得關(guān)鍵病情信息,幫助醫(yī)生更好評估治療效果和病情進展,這對于無法進行肝活檢的患者尤為重要。
HBV RNA水平可預(yù)測乙肝患者對NAs和干擾素兩類藥物的治療應(yīng)答。治療過程中,HBV RNA變化可評估用藥方案是否可以達到治療目標。此外,慢性乙肝患者鞏固治療時,若血清HBV RNA陽性,應(yīng)繼續(xù)抗病毒治療,以防復(fù)發(fā)風(fēng)險。
中國84%肝癌由乙肝導(dǎo)致,有研究表明HBV RNA相對于HBV DNA與肝癌的相關(guān)性更加緊密。HBV RNA陽性患者對比陰性患者肝癌發(fā)生風(fēng)險更高,因此臨床上高HBV RNA水平的病人應(yīng)該注意肝癌的早篩和監(jiān)測。
在血源感染性疾病檢測領(lǐng)域,圣湘生物乙肝、丙肝檢測產(chǎn)品連續(xù)多年全國室間質(zhì)量評價活動中實驗室用戶數(shù)保持第一,廣獲醫(yī)療機構(gòu)認可。
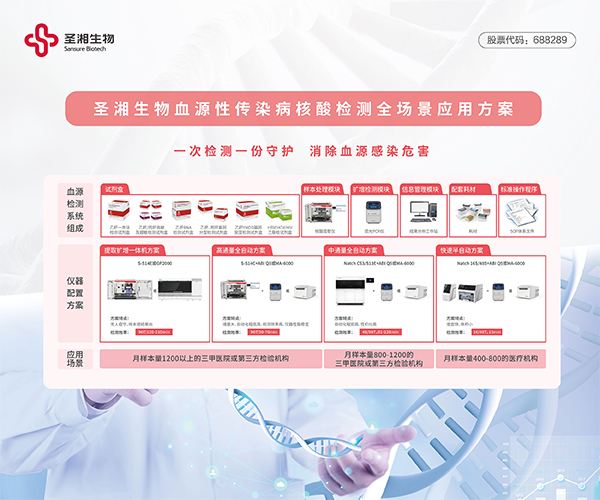
隨著HBV RNA檢測試劑盒的獲批,圣湘生物進一步完善肝炎全場景解決方案,全面覆蓋病毒性肝炎篩查確診、治療方案確定、療效評估、耐藥監(jiān)測、停藥風(fēng)險評估等全流程,搭配公司核酸提取擴增一體機、全自動核酸提取系統(tǒng)、半自動核酸提取方案,能夠提供適合不同醫(yī)療機構(gòu)、不同應(yīng)用場景,滿足不同階段、不同層級臨床需求的全面整體解決方案,為肝炎精準診斷提供新的有力工具。
未來,圣湘生物將繼續(xù)深耕肝炎防治領(lǐng)域,加大研發(fā)力度,推出更多創(chuàng)新產(chǎn)品,為肝炎患者的健康福祉貢獻更多力量。同時,公司也將積極參與國內(nèi)外肝炎防治合作與交流,推動肝炎防治事業(yè)持續(xù)發(fā)展,助力實現(xiàn)沒有肝炎的未來。

